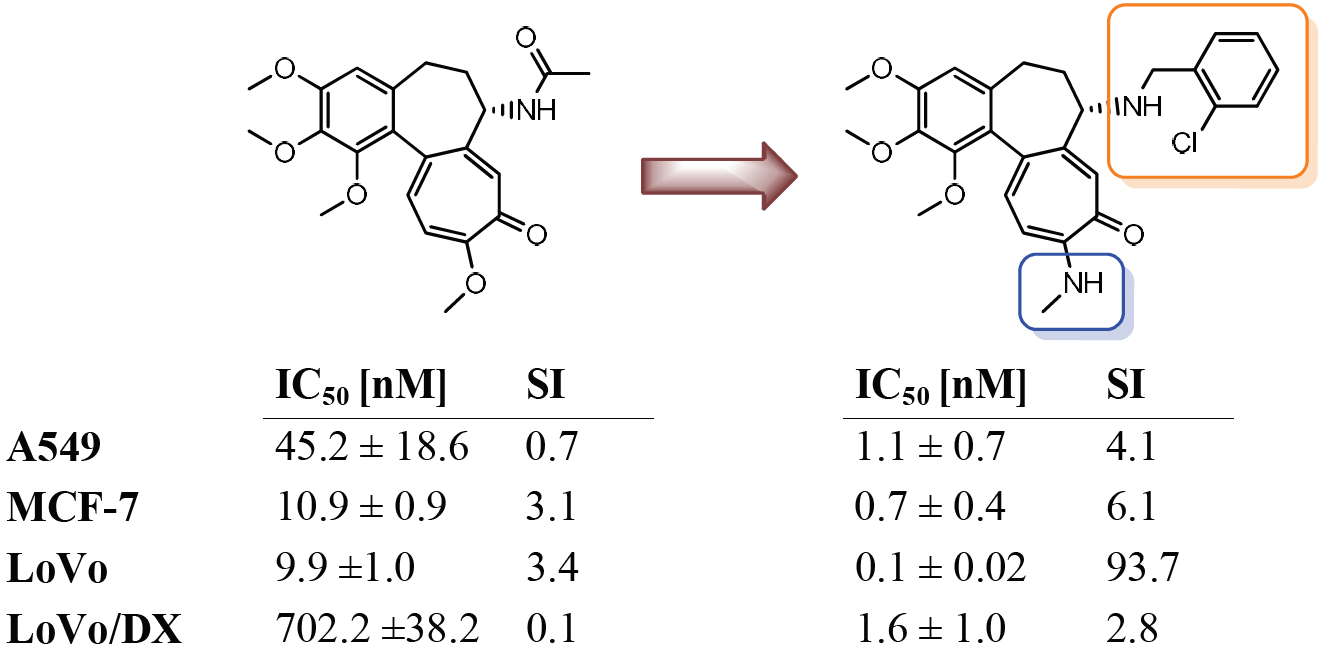
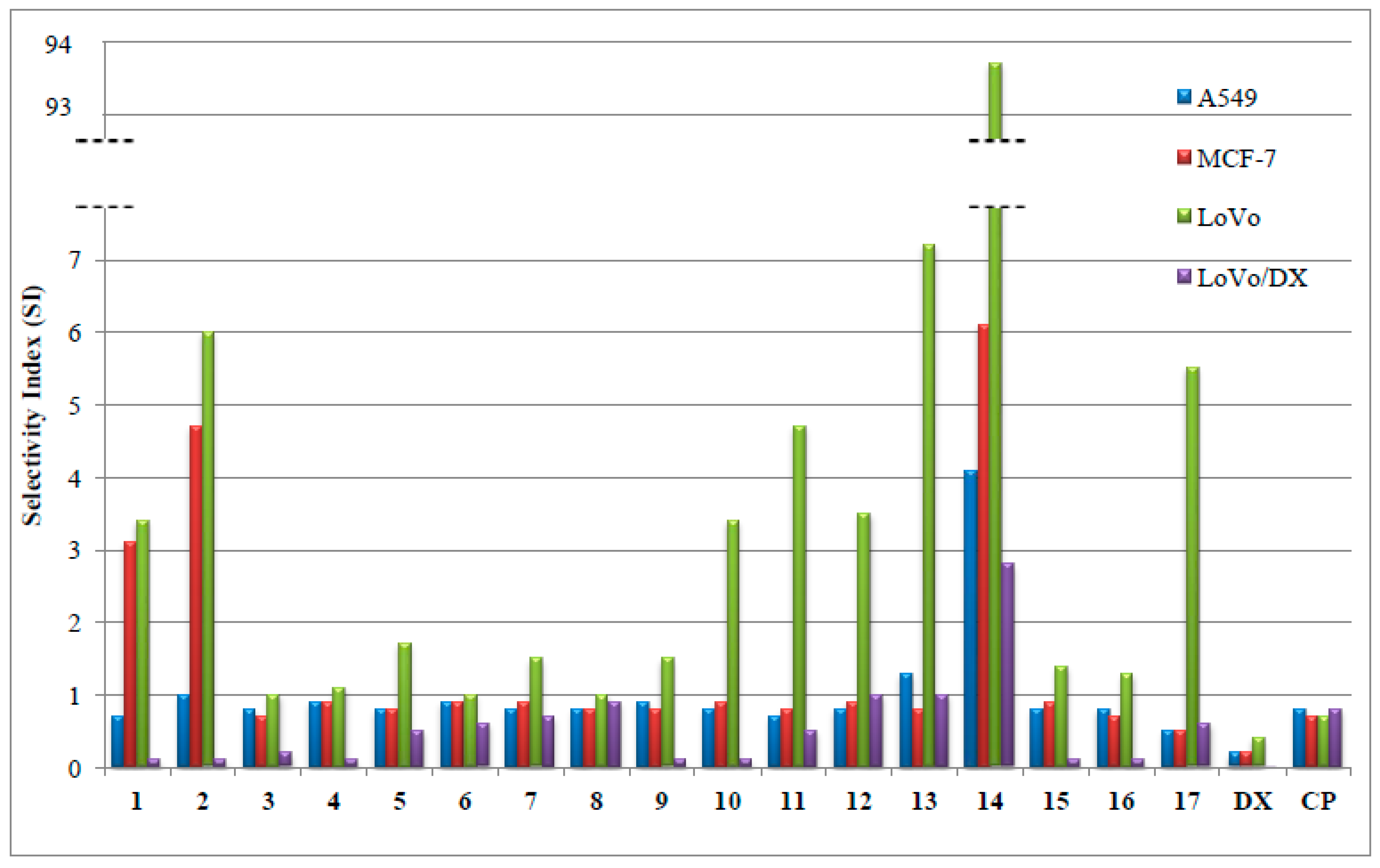
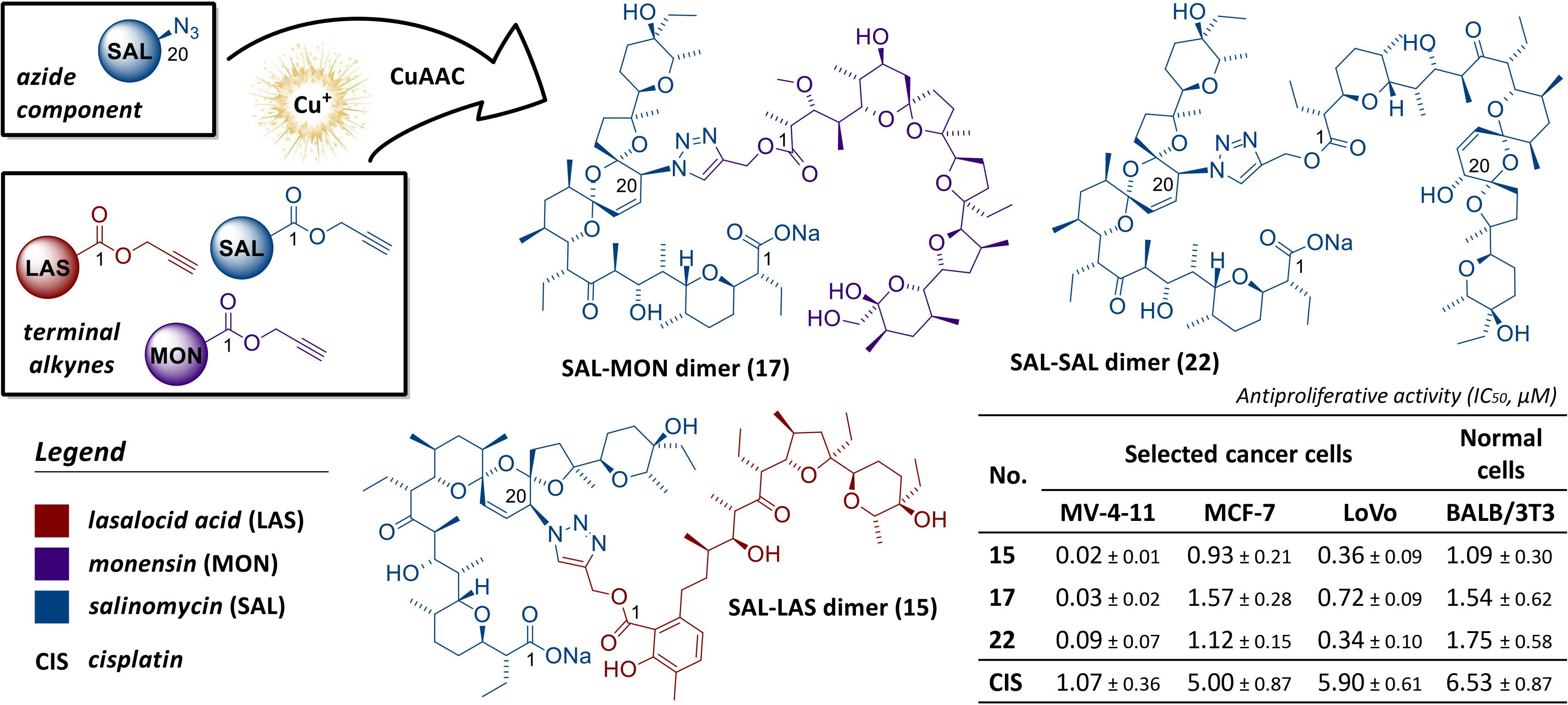
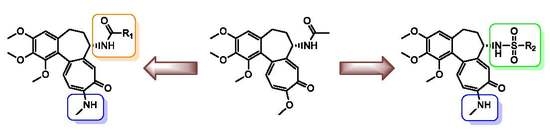
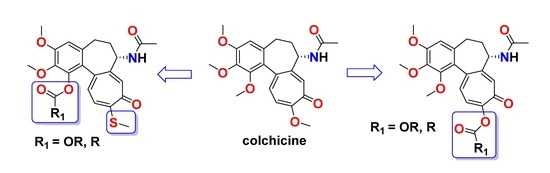
W wyniku kontynuowania współpracy z naukowcami z USA (Department of Biochemistry and Molecular Biology, University of Arkansas for Medical Sciences) przebadano serię 17 wybranych N-karbaminianowych pochodnych N-deacetylo-4-(bromo/chloro/jodo)tiokolchicyny na dwóch typach pierwotnych komórek nowotworowych obejmujących ostrą limfoblastyczną białaczkę (ALL) i ludzki nowotwór piersi (BC) pochodzące z dwóch różnych podtypów nowotworów, ER+ inwazyjny rak stopnia III (IDCG3) i rak z przerzutami (MC). Cztery z pochodnych kolchicyny były bardziej aktywne od związku wyjściowego w zakresie nanomolowych stężeń. Dodatkowo kilka otrzymanych pochodnych kolchicyny działało selektywnie na pierwotne komórki raka piersi w porównaniu do normalnego nabłonka piersi. Najbardziej obiecujące pochodne zostały następnie przetestowane na panelu NCI-60 (National Cancer Institute, USA) wobec aż 60 ludzkich nowotworowych linii komórkowych. Tak szeroko zakrojone badania przesiewowe pokazały, iż siedem spośród testowanych pochodnych kolchicyny miało silniejsze działanie cytotoksyczne od niemodyfikowanej kolchicyny m.in. przeciwko białaczce, niedrobnokomórkowemu nowotworowi płuc, a także nowotworom jelita grubego i prostaty. Dodatkowo kolchicynę i dwie najbardziej aktywne pochodne przebadano na aktywność ex vivo na uzyskanych od chorych pacjentów wycinkach przerzutowego nowotworu piersi (pobranych z wycinków pooperacyjnych). Uzyskane wyniki potwierdziły niezwykle wysoki potencjał przeciwnowotworowy nowych podwójnie i potrójnie zmodyfikowanych uretanów kolchicyny i tiokolchicyny.
Alicja Urbaniak, Fariba Jousheghany, Sergio Piña‐Oviedo, Youzhong Yuan, Urszula Majcher‐Uchańska, Greta Klejborowska, Anika Moorjani, Behjatolah Monzavi‐Karbassi, Adam Huczyński, Timothy C. Chambers, „Carbamate derivatives of colchicine show potent activity towards primary acute lymphoblastic leukemia and primary breast cancer cells – in vitro and ex vivo study”, J. Biochem. Mol. Toxicol., 2020;e22487. https://doi.org/10.1002/jbt.22487