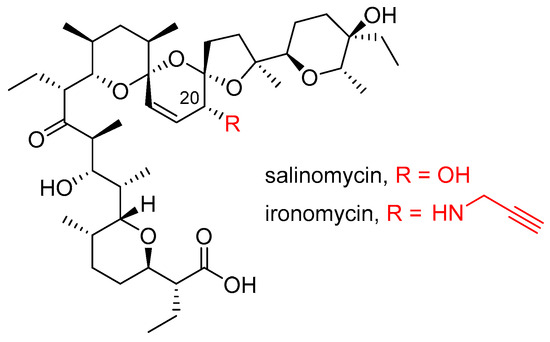
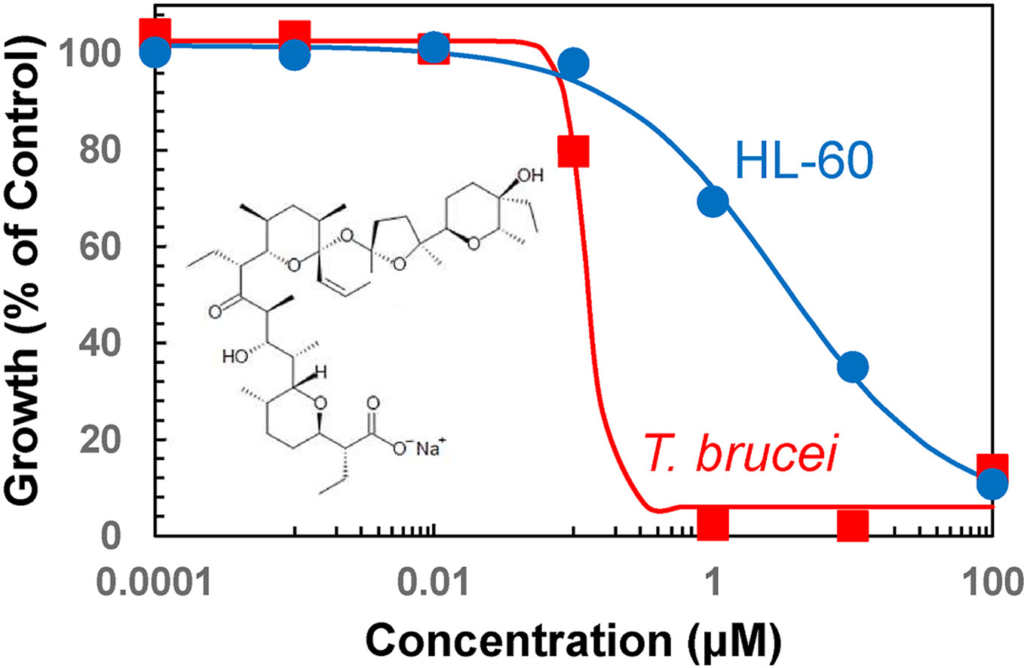
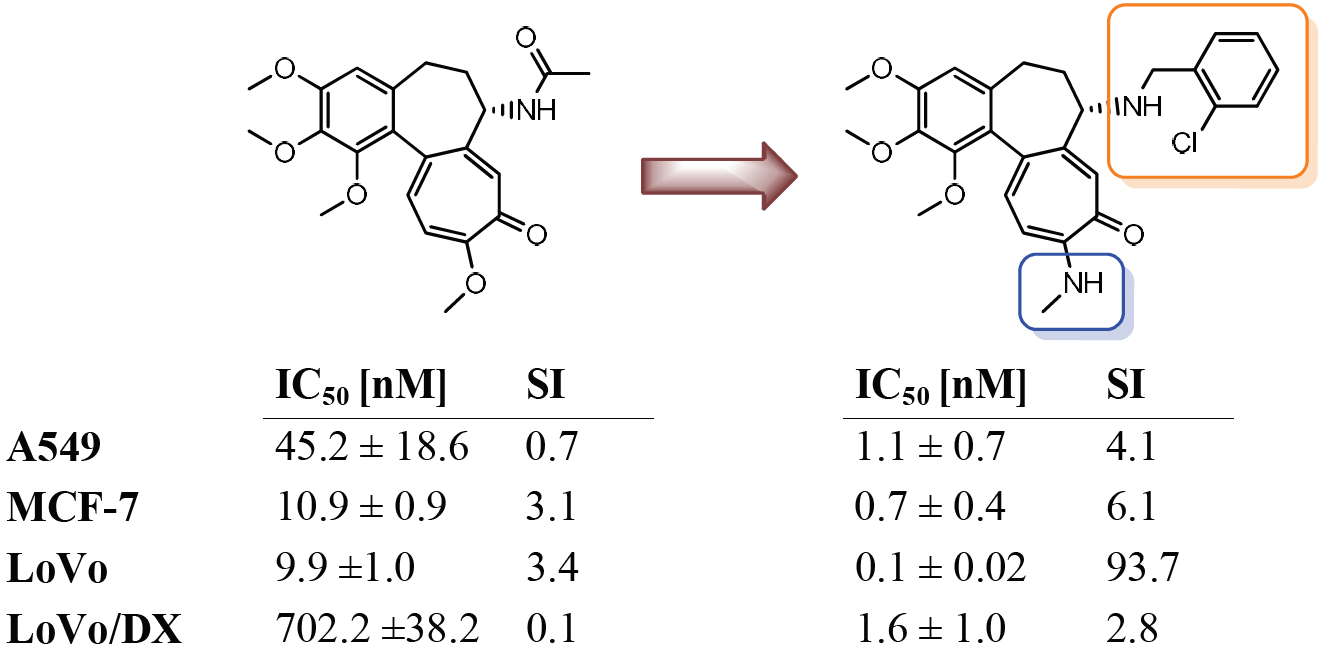
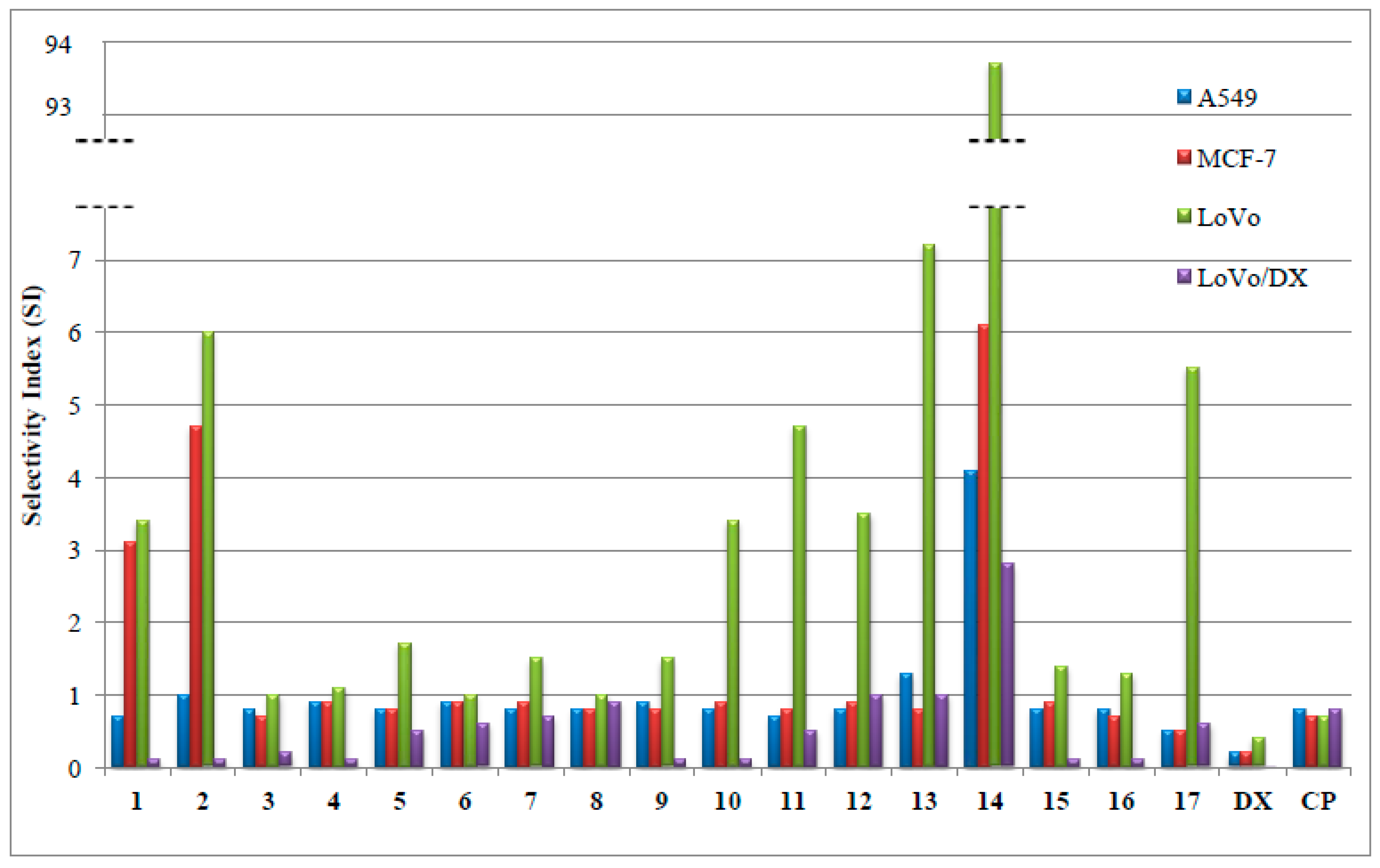
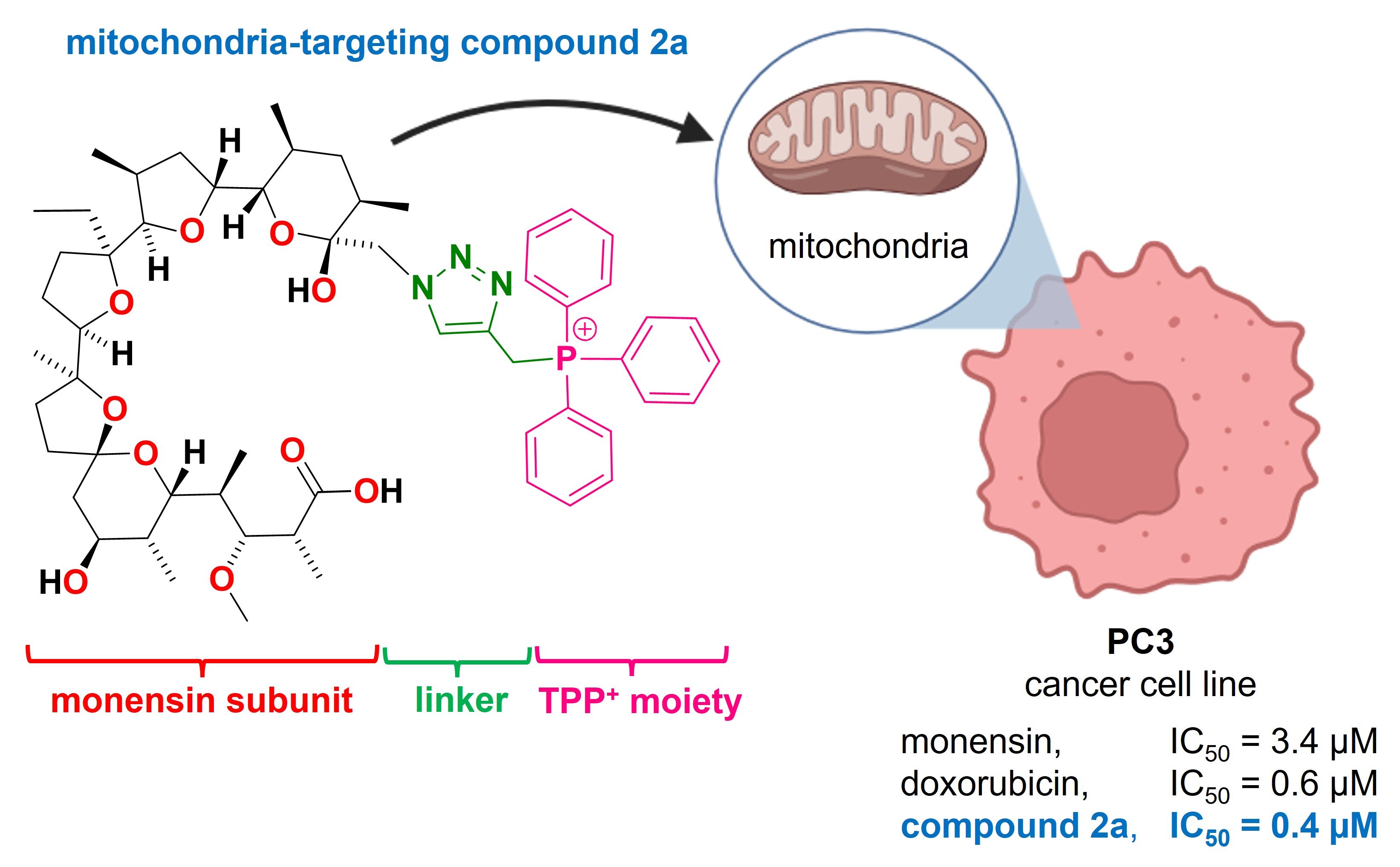
Badania nad terapiami przeciwnowotworowymi coraz częściej kierują uwagę naukowców na mitochondria – niewielkie „elektrownie” naszych komórek. Okazuje się, że to właśnie one mogą stanowić piętę achillesową komórek rakowych. Najnowsza praca badawcza dotycząca modyfikacji naturalnych związków jonoforowych, salinomycyny i monenzyny, pokazuje, że celowanie w mitochondria może znacząco zwiększyć skuteczność działania. Połączyliśmy jonofory z kationami trifenylofosfoniowymi, które naturalnie gromadzą się w mitochondriach komórek. Dzięki temu jonofory „podążają” za sygnałem elektrochemicznym prosto do mitochondriów komórek rakowych. Powstałe w ten sposób koniugaty nie tylko wykazały silniejsze działanie przeciwnowotworowe niż pierwotne związki, lecz także przewyższyły skutecznością popularny lek chemioterapeutyczny – doksorubicynę. Co więcej, część nowych cząsteczek potrafi dodatkowo zwiększać produkcję reaktywnych form tlenu w mitochondriach, co prowadzi do jeszcze intensywniejszego stresu oksydacyjnego i skuteczniejszego niszczenia komórek nowotworowych.
Wyniki badań sugerują, że wykorzystanie ukierunkowanego dostarczania substancji aktywnych do mitochondriów może stać się obiecującą drogą do tworzenia nowych, skutecznych terapii przeciwnowotworowych. To kolejny dowód na to, że walka z nowotworami nie musi polegać tylko na niszczeniu całych tkanek. Kluczem może być precyzyjne uderzenie w najbardziej wrażliwe elementy komórek nowotworowych.
Wyniki te potwierdziły hipotezę badawczą, którą postawiono w grancie NCN o tytule: ”Koniugaty celujące w mitochondria jako nowe środki przeciwnowotworowe”, kierowanym przez prof. Adama Huczyńskiego Badania finansowano z grantu Narodowego Centrum Nauki – OPUS 21 (2021/41/B/ST4/00088).
Michał Sulik, Marta Jędrzejczyk, Magdalena Mielczarek-Puta, Jakub Hoser, Piotr Bednarczyk, Marta Struga, Adam Huczyński, „Mitochondrial-Targeted Triphenylphosphonium-Conjugated Ionophores with Enhanced Cytotoxicity in Cancer Cells”, (2025), Molecules 30, no. 22: 4413, publikacja w otwartym dostępie
W badaniach uczestniczyły również dwa zespoły: zespół pod kierownictwem prof. Marty Strugi (Katedra i Zakład Biochemii, Wydział Lekarski, Uniwersytet Medyczny w Warszawie) i zespół prof. Piotra Bednarczyka (Katedra Fizyki i Biofizyki, Instytut Biologii, Szkoła Główna Gospodarstwa Wiejskiego w Warszawie).